פולימרים מוקצפים, בעלי יכולת התפרקות בגוף האדם, משמשים כמערכת לשחרור מבוקר של תרופות. היכולת לבצע סימולציה למערכת מקנה יכולות חיזוי חדשות בתחום
10 ינואר, 2019
המונח "תרופה" משמש אותנו בחיי יום-יום לתיאור תכשירים רפואיים המורכבים מהחומר הפעיל (API) האחראי לאפקט התרפויטי ומחומרים לא פעילים שנקבעים לפי צורת מתן התרופה. חומרים פעילים הנמצאים בתכשירים רפואיים כמו טבליות, משחות, קפסולות וכו' משתחררים בדרך כלל מהתכשיר בשחרור מיידי לאחר הנטילה. כאשר החומר הפעיל מגיע לדם, עולה הריכוז שלו למשך זמן מסוים ולאחר מכן יורד עד לנטילה הבאה.
שחרור מושהה או מבוקר של תרופות הוא טכנולוגיה המשמשת לשמירת ריכוז קבוע שלהן לאורך זמן על ידי שחרור הדרגתי מהתכשיר. לטכנולוגיה זו יש שימוש גם בחקלאות לשמירת ריכוז קבוע של חומרי דישון או הדברה בקרקע וכך מאפשרת להוריד את תדירות הדישון או ההדברה.
שיטות שונות לשחרור מבוקר של תרופות
קיימות טכניקות רבות להכנת מערכות לשחרור מבוקר או מושהה של תרופות (Controlled Drug Delivery Systems), לדוגמא: טכניקות המבוססות על כליאה של החומר הפעיל במאגר או במטריצה מצולבת שאינה מתפרקת, אולם מתרחבת ותופחת בסביבה מימית ומאפשרת דיפוזיה של החומר הפעיל החוצה; טכניקות המבוססות על התמוססות איטית של המטריצה ושחרור החומר הפעיל, או על פירוק איטי של הפולימר המרכיב את המטריצה. המערכת האחרונה מורכבת מפולימר פריק ביולוגית (biodegradable) שמפורק בגוף, בדרך כלל בעזרת אנזימים שנמצאים בסביבה ומזרזים פירוק של חומרים דומים במערכת הביולוגית. דוגמאות לפולימרים פריקים-ביולוגית שנמצאים בשימוש נרחב הם פולי-חומצה גליקולית PGA)), פולי-חומצה לקטית (PLA) ופוליקפרולקטון (PCL), שלושתם פוליאסטרים. לעיתים קרובות מכינים קופולימרים שלהם ביחסים שונים בכדי להגיע לזמני פירוק רצויים בהתאם למערכת. אפשרות נוספת לשליטה בקצב הפירוק הוא הכנת המערכת ממטריצה פולימרית מוקצפת/פורוזיבית עם גודל משתנה של חללים ובה נתמקד במאמר זה.
מטריצה פולימרית מוקצפת כאמצעי לשחרור מבוקר של תרופות
אחת הטכנולוגיות להכנת מטריצה פולימרית פורוזיבית/מוקצפת היא תהליך מבוקר להתפשטות של פולימרים רוויים, Controlled Expansion of Saturated Polymers process (CESP) (איור 1).
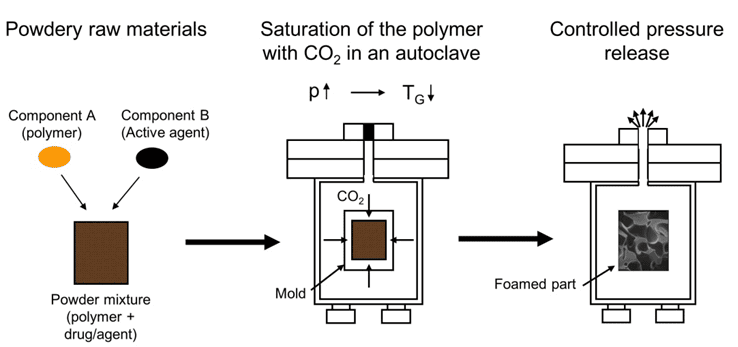
איור 1: תיאור התהליך המבוקר להתפשטות של פולימרים רווייםControlled Expansion of Saturated Polymers process (CESP)
מקור: Hopmann C., Kaltbeitzel D., Kauth Th., Daentzer D., Kalla K., Welke B., Kujat B., Resorbable spinal implants, Kunststoffe 2013, 103(2), 61-63.
בתהליך זה הפולימר, המעורבב עם החומר הפעיל (תרופה), נחשף לגז אינרטי (בדרך כלל (CO2 בלחץ גבוה בתוך אוטוקלב עד לרוויה. הורדה מבוקרת של הלחץ מביאה להיווצרות חללים מיקרוסקופיים במטריצה. גודל החללים וצפיפותם מאפשרים לשלוט בקצב התפרקות הפולימר ושחרור התרופה. יתרון נוסף של החדרת הגז והקצפת הפולימר הוא שהדיפוזיה של הגז האינרטי גורמת להקטנת כוחות הוואן דר-ואלס בין מולקולות הפולימר ולירידה בטמפרטורת המעבר הזכוכיתי (Tg), כלומר לריכוך הפולימר. האפקט המרכך מאפשר עיבוד של הפולימר בטמפרטורות נמוכות יחסית, דבר חשוב במיוחד בהקשר של מערכות לשחרור מבוקר מכיוון שגם הפולימר וגם החומר הפעיל הם לעיתים קרובות רגישים לחום.
אפיון של מערכת פולימרית מוקצפת ומתפרקת ביולוגית בניסויי מעבדה ובסימולציה אטומיסטית
דוגמא לפולימרים פריקים ביולוגית ששימשו לבניית מערכות לשחרור מבוקר של תרופות בטכנולוגית CESP מופיעה בטבלה 1. הפולימרים הנקראים Resomer 1 ו- Resomer 2 הם קופולימרים של חומצה לקטית וחומצה גליקולית הקשורים לשרשרת פוליאתילן גליקול (PEG), בעלת שני אורכים. PCL הוא פוליקפרולקטון.
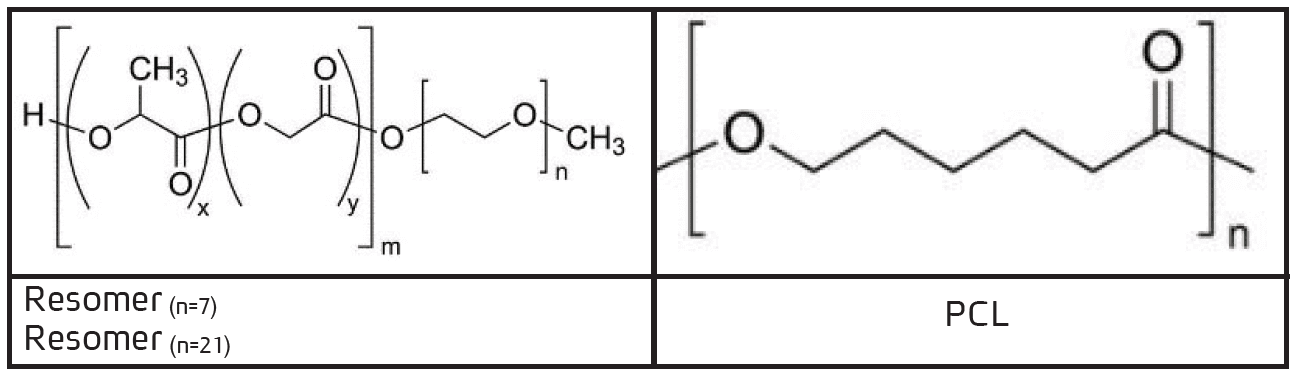
טבלה 1: פולימרים פריקים ביולוגית ששימשו לבניית מערכות לשחרור מבוקר של תרופות
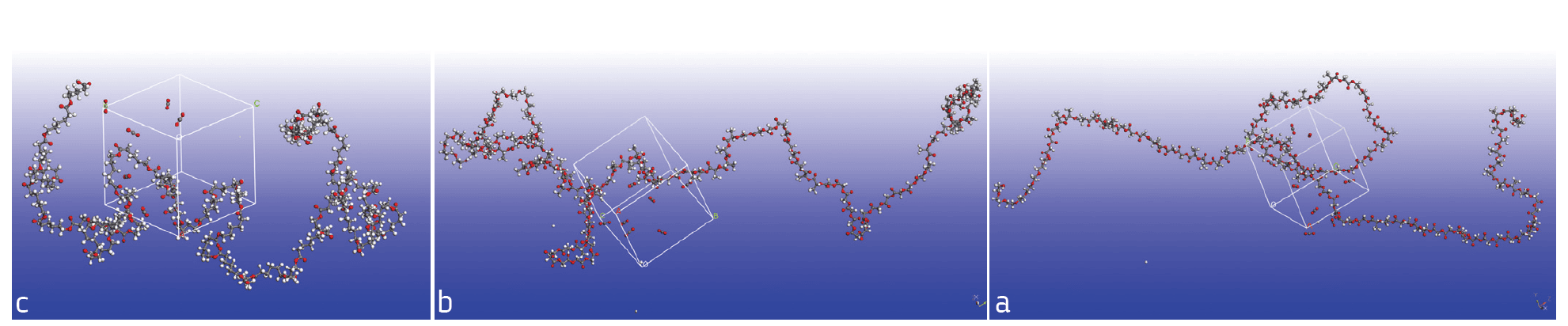
פולימרים אלה נבדקו הן בניסויי מעבדה והן בסימולציה אטומיסטית. באיור 2 ניתן לראות את תמונת התאים המחזוריים שנבנו בסימולציה, הכוללים כל אחד מולקולת פולימר אחת מכל סוג ושמונה מולקולות CO2.
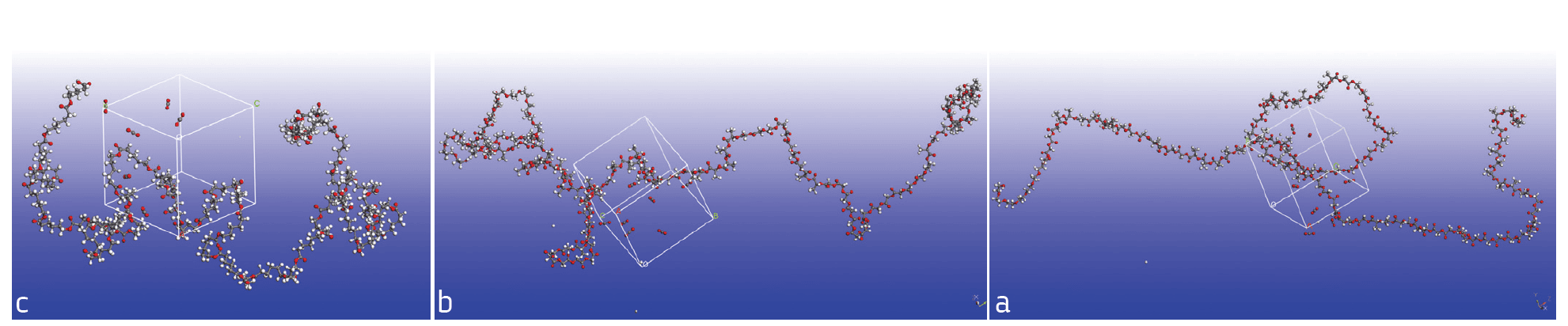
איור 2: תאים מחזוריים לאחר סימולציה דינמית. מכילים מולקולת פולימר אחת עם שמונה מולקולות CO2. a – Resomer 1; b – Resomer 2; c – PCL
צפיפות וגודל החללים הנוצרים מאפשרים לשלוט על קצב שחרור התרופה מהפולימר. לשם כך, בשלב ראשון אופיינה האינטראקציה בין הגז (CO2) שיוצר את החללים ובין הפולימר: בסימולציה חושבו ערכי פרמטר המסיסות של תערובות של הפולימרים עם CO2 ביחסים שונים (איור 3). פרמטר המסיסות הוא מדד הקשור לחוזק האינטראקציות בין מולקולות וליכולת חומרים (הגז והפולימר) להתערבב האחד עם השני. כמגמה כללית, ערכי פרמטר המסיסות יורדים על עליית השבר המשקלי של CO2, אולם נראה שיש ערך מקסימלי בריכוז של כ-5% משקלי של CO2. ריכוז זה דומה לערך שהתקבל עבור ריכוז הרוויה של CO2 בפולימרים השונים במערכת הניסויית. נראה שבריכוז זה האינטראקציות הן אופטימליות. מכאן שחישוב פרמטר המסיסות יכול להוות אינדיקציה לריכוז הרוויה של CO2.
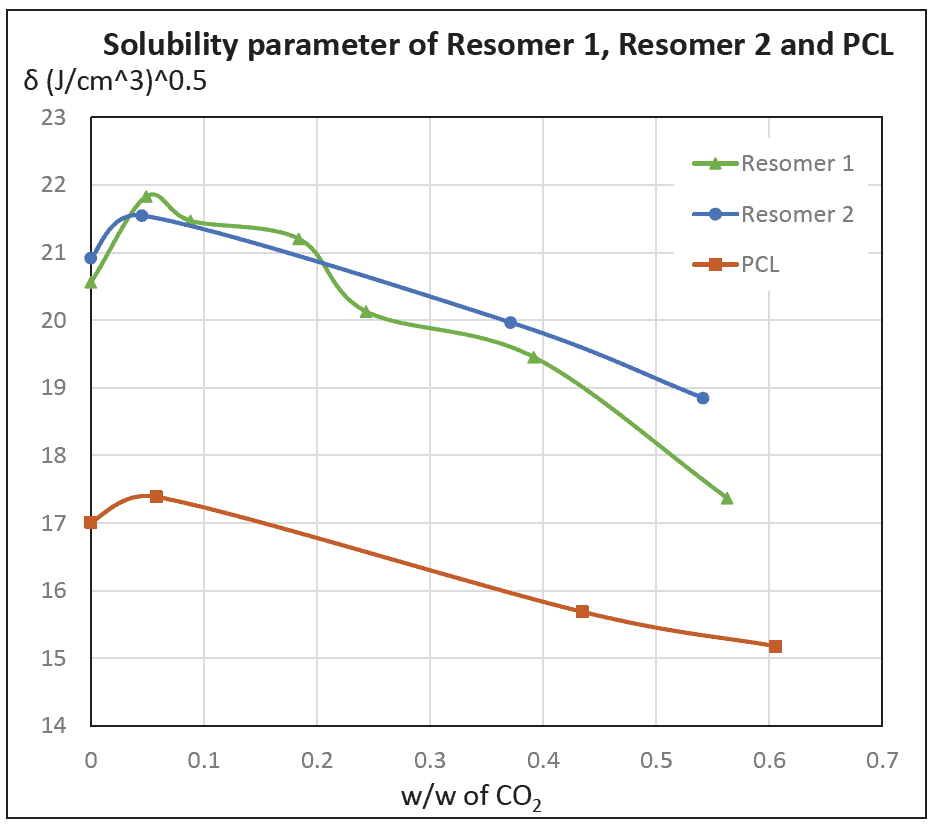
איור 3: ערכי פרמטר המסיסות שחושבו בסימולציה האטומיסטית של מערכות הכוללות פולימרים עם CO2 ביחסים שונים (לפי השבר המשקלי של (CO2.
יתרון נוסף של הפולימר המוקצף הוא שההקצפה גורמת לריכוך הפולימר וכך מאפשרת לעבד אותו בטמפרטורה נמוכה יחסית. בכך נמנעת פגיעה הן בפולימר והן בתרופה שבתוכו. ריכוך של פולימרים בא לידי ביטוי בירידה בטמפרטורת המעבר הזכוכיתי (Tg) שלהם בשל הגדלת הנפח החופשי, המקלה על יכולת הפיתול של מקטעי השרשרת הפולימרית. בכדי לבדוק בסימולציה האם ובאיזו מידה עברו הפולימרים ריכוך כתוצאה מהחשיפה ל-CO2, נעשה מעקב אחרי קצב הדיפוזיה של אטומי הליום במטריצה הפולימרית כתלות בריכוז ה-CO2. אטומי ההליום נבחרו כגשש מאחר והם אטומים קטנים ואינרטיים ואין חשש שהם ייצרו אינטראקציה עם המטריצה הפולימרית. באיור 4 נתן לראות שקצב הדיפוזיה של אטומי ההליום עולה ככול שהשבר המשקלי של ה-CO2 עולה, דבר המעיד על עלייה בנפח החופשי בפולימר, כלומר עלייה בריכוך.
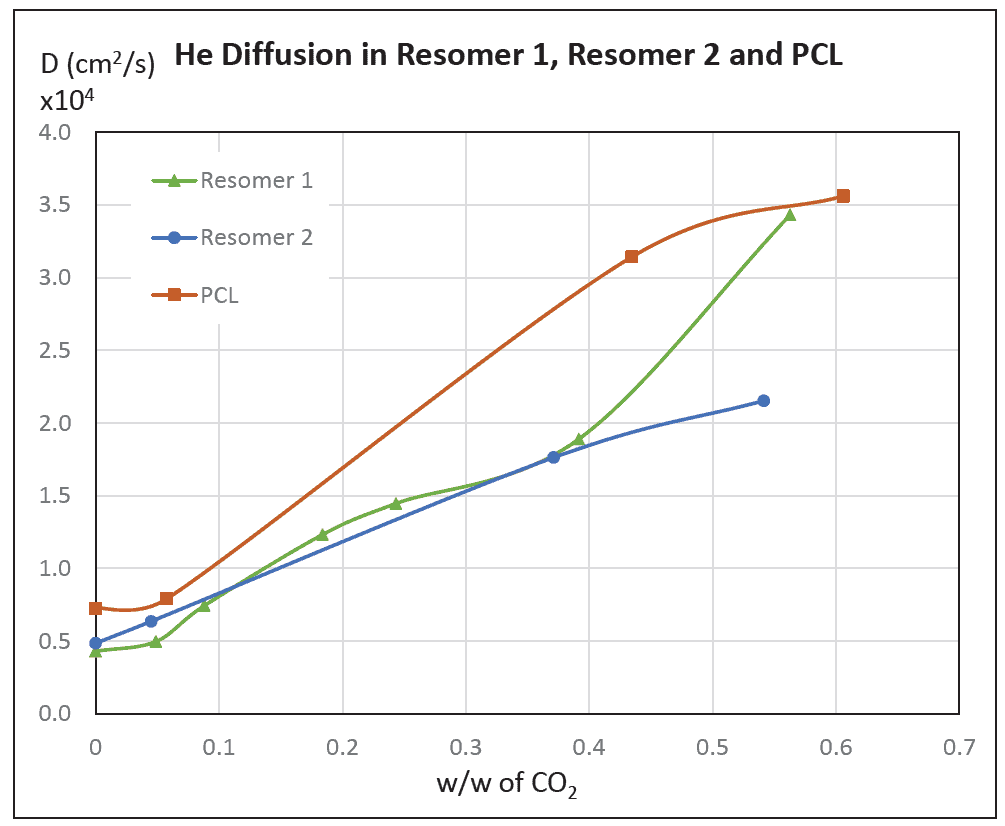
איור 4: קצב הדיפוזיה של אטומי הליום שחושבו בסימולציה אטומיסטית של מערכות הכוללות פולימרים עם CO2 ביחסים שונים (לפי השבר המשקלי של (CO2.
סיכום
בעבודה זו אפיינו מערכת לשחרור מבוקר של תרופות המבוססת על מטריצה פולימרית מוקצפת המתפרקת ביולוגית, שמכילה בתוכה את החומר הפעיל (תרופה). הראנו את הסינרגיה בין מחקר ניסויי למחקר חישובי וכיצד כל אחד מהם תורם להבנה טובה יותר של המערכת.
הסימולציה מהווה בשנים האחרונות חלק חשוב במחקרים רבים הן כאמצעי לתיאור והבנת המערכת והן ככלי לחיזוי. מגמה זו קיימת הן בתחום תכנון תרופות והן בתחום החומרים, והיא הולכת ומתחזקת עם התפתחות התוכנות המשמשות להדמייה ושיפור הדיוק שלהן, ועלייה בחוזק המחשבים שעליהם נערכות ההרצות.
על הכותבת

ד"ר דפנה כנעני
ד"ר דפנה כנעני היא מרצה בכירה במחלקה להנדסת ביוטכנולוגיה, המכללה להנדסה ע"ש בראודה בכרמיאל. בארבע השנים האחרונות היא משמשת כראשת התכנית לתואר שני בביוטכנולוגיה. ד"ר כנעני למדה את שלושת תאריה (BA, MSc, (DSc בפקולטה לכימיה בטכניון וכן תואר MBAבאוניברסיטת חיפה. בעבר היא עבדה בחברת ההזנק Surgical Bio-Polymeric Materials Ltdובתמ"י – מכון למחקר ופיתוח, כימיקלים לישראל. היא היתה מדענית אורחת במכון לעיבוד חומרים פלסטיים IKV באוניברסיטת RWTH באאכן, גרמניה.
ד"ר כנעני התמחתה במהלך לימודיה בתחום הכימיה של פולימרים (תגובות פלמור במנגנוני סיפוח ודחיסה. אפיון פולימרים – משקלים מולקולריים, התנהגות תרמית אפיון מבנה וכו'), ובכימיה של תרכובות קיראליות (שיטות ביוטכנולוגיות להכנת תרכובות נקיות אופטית. אפיון מבנה ופעילות אופטית). היא היתה בין הראשונים שערכו תגובות פלמור בקטליזה אנזימטית במדיום אורגני. ב-15 שנים האחרונות היא עוסקת בסימולציה מולקולרית של חומרים וביוחומרים תוך שימוש בתוכנות מתקדמות לסימולציה של תערובות פולימרים, פולימרים עם תוספים ומלאנים, פולימרים טבעיים עם תרופות שונות וכו'.
למידע נוסף: dk****@*******ac.il